
Алексей ПРОКОПОВ, кандидат медицинских наук, Лаборатория новинок «РОС-Химия» (Екатеринбург)
ОСНОВНЫЕ ПРЕДСТАВИТЕЛИ МИКРОБИОТЫ КОЖИ
Staphylococcus epidermidis (эпидермальный
стафилококк)
Этот грамположительный аэроб из типа Firmicutes составляет более 90% всей аэробной флоры кожи. Обладает симбионтными свойствами в стимулировании локального иммунитета и обеспечении более высокого защитного уровня против ряда патогенов. Ряд авторов указывают на его более значимую и выраженную мутуалистичность (а именно биологическое взаимодействие к обоюдной выгоде обоих партнеров), чем, например, у кишечной палочки (рис. 1).
Микроорганизм позитивно воздействует на кожу, а именно:
- производит собственные антимикробные вещества, повышая антимикробный потенциал кожи
- усиливает и ускоряет керацитарный ответ на патогены, включая стимуляцию синтеза кератиноцитами собственных эпидермальных антибиотических веществ (иммунный праймер)
- обеспечивает улучшение механических барьерных свойств кожи (усиление плотных межклеточных примыканий tight junction)
- способствует снижению провоспалительного потенциала в коже
- является прямым антагонистом S.aureus
В таблице 4 приведены основные антибактериальные субстанции, синтезируемые S.epidermidis.
В процессе жизнедеятельности S.epidermidis синтезирует фенолрастворимый белок медулин (PSMγ и PSMδ), который состоит из 2 половин – гидрофильной и гидрофобной, что копирует свойства кателицидина LL-37. Кроме того, S.epidermidis синтезирует лантибиотики (лантионинсодержащие антибактериальные пептиды, или бактериоцины), а также способствует синтезу кератиноцитами дефензима-2.
В целом S.epidermidis калибрует реакцию кератиноцитов на патоген, загружая рецепторы TLR-2 липотейхоевой кислотой, которая обеспечивает стимулирование иммунного ответа. Параллельно снижает провоспалительный потенциал в коже и усиливает плотные белковые межклеточные примыкания tight junction через рецепторы TLR-3.
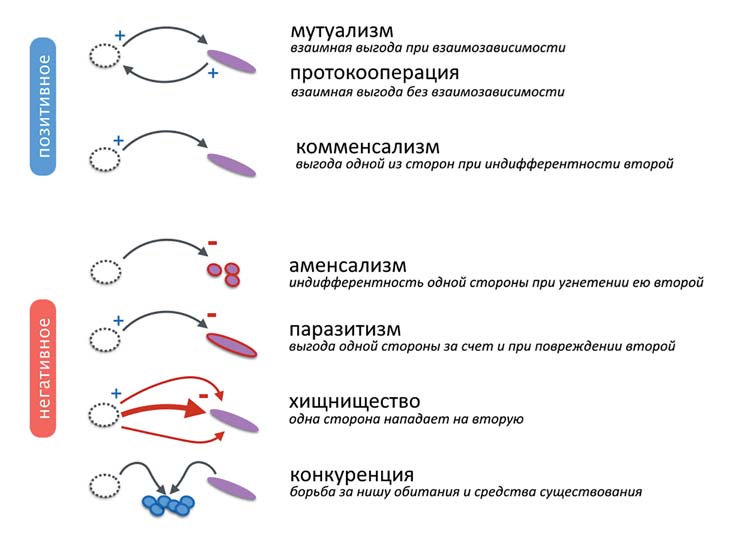
РИС. 1. Типы взаимодействия микроорганизмов в микробиоте
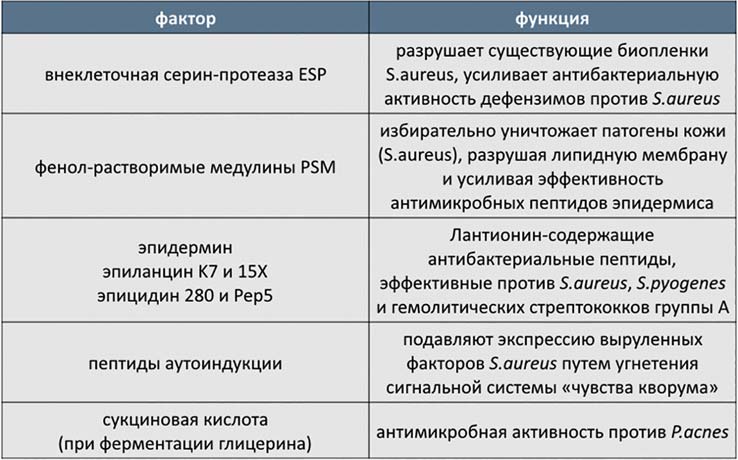
ТАБЛИЦА 4. Основные антибактериальные субстанции, синтезируемые S.epidermidis
S.epidermidis обладает выраженным угнетающим действием на S.aureus, патогенные гемолитические стрептококки группы A и E.coil. S.epidermidis способен нарушать образование биопленки S.aureus, прямо разрушать ее и/или усиливать восприимчивость S.aureus к иммунным факторам кожи.
Такие качества S.epidermidis, как стимулирование иммунных свойств кожи и выработка собственных антибиотических пептидов, важны для поддержания стабильности микробиома кожи. Тем не менее при миграции его в иную нишу обитания возможны осложнения. Так, именно S.epidermidis является источником обсеменения венозных катетеров у госпитальных больных или искусственных сердечных клапанов. При этом S.epidermidis образует биопленку, защищающую его от иммунной системы человека или антибиотиков. Более того, именно этот микроорганизм чрезвычайно устойчив к оксациллину и метициллину и, являясь микробиомным резервуаром (депо), распространяет антибиотикорезистентные свойства другим бактериям микробиоты (особенно S.aureus).
S.aureus (золотистый стафилококк)
Этот грамположительный кокк, аэроб из типа Firmicutes, является важнейшим элементом микробиома кожи, особенно при ее патологических состояниях. Именно так, через призму его вовлечения в нозокомиальные инфекции, до последнего времени и рассматривалась биологическая роль S.aureus, что оставляло за скобкой его роль как представителя нормальной микрофлоры. Сегодня его относят скорее к бактериям-комменсалам (рис. 1).
Основной ареал существования S.aureus – передняя носовая полость. 20% населения являются постоянными носителями этого микроорганизма, 60% – транзитными носителями. Предрасполагающим фактором к этому может быть наличие определенных генов и неспособность синтезировать натуральный биоцид триклозан слизистой носа.
S.aureus способен синтезировать бактериоцины, устойчив к фагоцитозу (за счет формирования капсулы) и катионным антимикробным белкам организма; каротиноидный пигмент помогает ему противостоять окислительному стрессу. S.aureus генерирует большое количество вирулентных факторов, которые реализуются при снижении иммунных свойств организма хозяина: угнетение хемотаксиса нейтрофилов, подавление экстравазальной миграции лейкоцитов. Арсенал секретируемых экзотоксинов включает суперантигенные токсины, а также ферменты деструкции матрикса (гиалуронидазы, протеазы, липазы). Кроме того, S.aureus вырабатывает δ-токсин, прямо вызывающий дегрануляцию тучных клеток дермы и развитие воспалительного процесса. Как ни парадоксально, часть этих агрессивных факторов S.aureus может быть полезна для организма человека (рис. 2).
Именно штаммы S.aureus резистентны к ß-лактамным антибиотикам, амногликозидам, тетрациклинам и гликопептидам. S.aureus может быть причиной развития как локальных кожных патологий (фурункулез, фолликулит, пиодермий), так и системных септических состояний, остеомиелитов, артритов, эндокардитов. Ассоциирован с атопическим дерматитом. Тем не менее в научной литературе появляется все больше данных о важности присутствия S.aureus на коже и его роли в нормальной микробиоте кожи.
Propionibacterium acnes
Грампозитивная палочка, кислородоустойчивый (факультативный) анаэроб, относящийся к типу Actinobacteria. Одним из метаболитов его жизнедеятельности является пропионовая кислота, которая и дала название микроорганизму.
Отношения с кожей можно классифицировать как мутуализм (рис. 1). Большая роль принадлежит P.acnes в помощи макроорганизму при защите от патогенов.
Propionibacterium acnes оснащен спектром липаз и способен расщеплять жиры. Гидролиз триглицеридов и насыщение поверхности кожи свободными жирными кислотами приводят к ацидификации кожи, что является угнетающим фактором для роста потенциально патогенных S.aureus, S.pyogenes. Свободные жирные кислоты обеспечивают лучшую поверхностную адгезию данной бактерии с последующей колонизацией внутренних отделов сальных желез. Микроорганизм высоко чувствителен к УФ-облучению ввиду высокого содержания УФ-абсорбера порфирина, способен синтезировать бактериоцины и подобные им вещества.
К вирулентным факторам P.acnes относятся ферменты, которые облегчают адгезию и колонизацию просвета сальной железы. Церамидазы и гиалуронидазы обеспечивают разрушение перифокального матрикса, способствуя инвазии микроорганизма. P.acnes способны формировать биопленки, устойчивые к воздействию антибиотиков. В развитии воспаления играет роль загрузка кератоцитарных рецепторов TLR-2 и TLR-4 с последующей выработкой стимулированными кератиноцитами провоспалительных IL-6, IL-8, IL-1 и TNF-a. Все это способно приводить к гиперкератозу (например, в устьях сальных протоков).
P.acnes ассоциирован с акне, может также вызывать фолликулиты и саркоидоз, быть причиной послеоперационных осложнений у ослабленных больных (эндокардиты, сепсис). В офтальмологической практике является причиной эндофтальмитов.
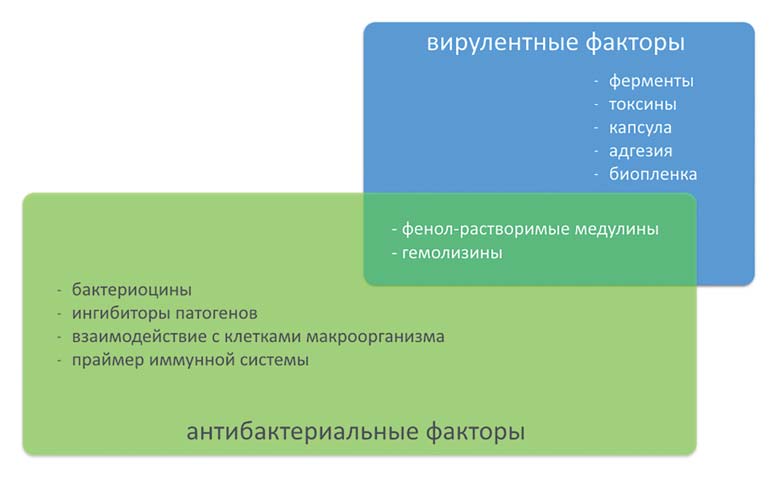
РИС. 2. Соотношение вирулентных и антимикробных факторов S.aureus
Pseudomonas aeruginosa (синегнойная палочка)
Грамотрицательная подвижная палочковидная бактерия типа Proteobacteria. Может синтезировать сине-зеленый флюоресцирующий пигмент (за что и получила свое название). Несмотря на то, что является этиологическим фактором некоторых нозокомиальных инфекций, относится учеными к группе мутуалистичных бактерий (рис. 1). Считается таким же важным представителем резидентной микрофлоры кожи, как S.epidermidis.
Редкость ассоциированных с P.aeruginosa заболеваний, мощное сопротивление другим микроорганизмам, включая дрожжеподобные грибы, – факторы, которые являются основанием для утверждения, что данная бактерия предотвращает заболевания, поддерживая гомеостаз в системе взаимодействия «макроорганизм – микроорганизмы».
Метаболическая гибкость позволяет P.aeruginosa легко приживаться в нишах разнообразной экологии, его можно найти во многих тканях человека. Продукты жизнедеятельности микроорганизма обладают мощным антибактериальным действием (например, псеудомоновая кислота, известная в медицине как мупироцин, применяется в качестве антибиотиков при стрептококковых и стафилококковых инфекциях кожных покровов). Метаболиты P.aeruginosa обладают мощным действием против дрожжевых грибков Candida, подавляя фазу вирулентного роста C.albicans. Возможно, это происходит благодаря сигнальным молекулам, формирующим бактериальное «чувство кворума» и содружественную реакцию популяции бактерий для приспособления к особенностям среды и собственной защиты. Отмечено его антагонистическое действие и против H.pylori.
P.aeruginosa способен синтезировать альгинат – полисахаридный матрикс, являющийся фактором адгезии и защиты от фагоцитоза. Кроме того, микроорганизм синтезирует набор экзотоксинов и ферментов (протеаз, липаз, эластазу).
Заболевания вызывает крайне редко - только у ослабленных пациентов (ассоциирован с госпитальными инфекциями).Часто встречается при ожоговой болезни, может быть источником инфекций костей, суставов, желудочно-кишечного и дыхательного тракта. Может стать причиной дерматитов, часто при контакте с горячей водопроводной водой. Отмечается рост мультирезистентности к антибиотикам, особенно у госпитальных штаммов.
Corynebacterium jeikeium
Грампозитивный факультативный анаэроб типа Actinobacteria, для жизнедеятельности которого необходимы ионы железа и марганца. Последние входят в состав фермента супероксиддисмутаза, помогающего противостоять окислителям и свободным радикалам любого происхождения.
Corynebacterium jeikeium, так же как и S.epidermidis, относится к резидентной флоре кожи, особенно часто встречается в подмышечной впадине и паховой складке. Скорее относится к мутуалистичным бактериям, чем к комменсалам (рис. 1), поскольку обеспечивает дополнительную защиту эпидермису (в том числе и от свободных радикалов). Активный механизм поглощения ионов железа обеспечивает вытеснение других микроорганизмов с колонизируемой поверхности. Corynebacterium jeikeium синтезирует бактериоцины, имеет факторы вирулентности, адгезии и инвазии, подобные таковым у других грампозитивных бактерий. Ассоциирован с нозокомиальными инфекциями, чаще всего встречается у ослабленных больных при нарушении целостности кожного барьера. Может быть источником эндокардита и сепсиса, высокорезистентен к антибиотикам.
МИКРОБИОТА ПРИ ПАТОЛОГИИ
Совместная с бактериями жизнь оказывает огромное влияние на состояние здоровья человека. Бактерии столь тесно связаны с метаболизмом, что качественные и количественные изменения микробиоты грозят серьезными нарушениями обмена в организме. Это приобретает особое значение в разрезе неинфекционных заболеваний человека.
Изучение этого вопроса с точки зрения баланса в трехкомпонентной системе «микроорганизмы – клетки (кожи) – факторы окружающей среды» (рис. 6) позволяет оценивать роль микробиоты в здоровом организме и при развитии заболеваний как в виде этиологического, так и патогенетического фактора.
Как сказано выше (рис. 4), факторов (популяционных, индивидуальных), влияющих на состав микробиоты, множество. И их значение еще предстоит осознать: мытье рук для профилактики заболеваний – это не только удаление патогена, но и своего рода «ураган» (или «лесной пожар»), существенным образом, хоть и кратковременно, переформатирующий микробиоту рук. Антибиотики не убивают все патогены, но изменяют баланс в микробиоте, что обуславливает снижение патогенности возбудителя. Транзитная микрофлора способна существенным образом вторгаться, нарушать баланс и оказывать влияние на макроорганизм как самостоятельно, так и посредством влияния на резидентные бактерии. Причем вероятно, что особая роль при этом принадлежит транзитной микробиоте рук, формирующей определенный микробиотический вектор, воздействующий на другие участки кожного покрова (особенно лица).
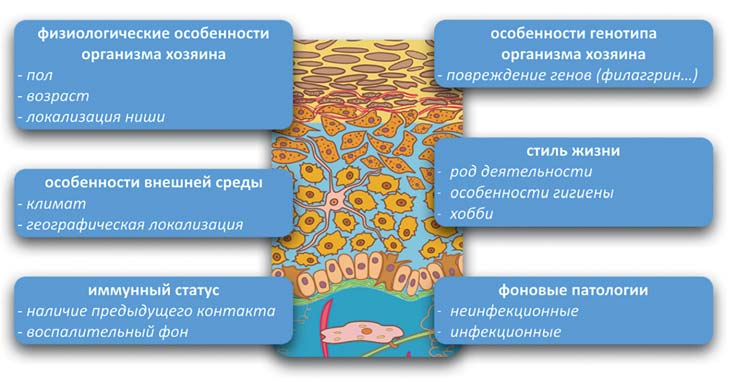
РИС. 4. Факторы, определяющие разнообразие микробиоты кожи
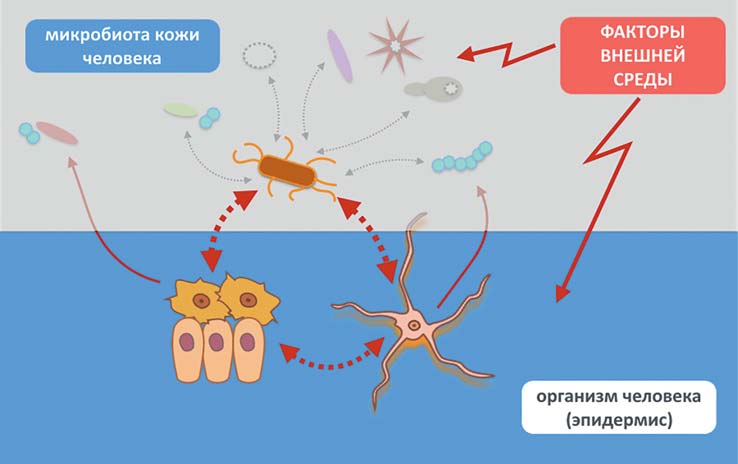
РИС. 6. Принципиальная схема взаимодействия в системе «микроорганизмы – клетки (кожи) – факторы окружающей среды»
Изменение/нарушение одного из компонентов триады тянет за собой коррекцию остальных:
- изменение состояния организма хозяина влечет изменение микробиоты – например, мутация гена филаггрина, в том числе при атопическом дерматите, приводит к снижению эффективности кератинизации и нарушению формирования эпидермального барьера. Увеличивается TEWL, изменяются условия на поверхности кожи и восприимчивость последней к факторам внешней среды. Как следствие, происходит изменение микробиоты в виде активного расселения S.aureus;
- изменение микробиоты ведет к изменению состояния организма хозяина – например, при ожирении существенное изменение микробиоты кишечника радикальным образом меняет обмен веществ в организме человека. В этом же ряду стоит и влияние транзиторной флоры, но это еще предстоит детально изучить.
Сдвиг микробного спектра с нарушением типичного баланса микроорганизмов, присущего конкретной нише обитания, зачастую с чрезмерным представительством каких-либо микроорганизмов называется дисбиозом, или дисбактериозом. Казалось бы, кожа из-за частой травматизации и постоянного контакта с болезнетворными бактериями должна быть хорошо подготовлена к смене микроокружения. Тем не менее дисбиоз кожных покровов встречается довольно часто и не менее опасен, чем дисбиоз кишечника.
Дисбиоз – это состояние, характеризующееся нарушением состава и свойств микробиоты, что непременно оказывает влияние на макроорганизм. Дисбиоз может быть кратковременным или долговременным. Может быть первопричиной нарушения баланса в системе «микроорганизмы – клетки (кожи) – факторы окружающей среды» или следствием. Дисбиоз может сам быть заболеванием или лишь сопровождать манифестацию другого патологического процесса/заболевания. Дисбиотические состояния лежат в основе многих инфекционных и неинфекционных заболеваний . Инфекционный процесс – это дисбиотическое состояние с аномальным превалированием, как правило, одного возбудителя в составе микробиоценоза.
Дисбиоз определяет риск развития и степень проявления патологического состояния или заболевания, но не всегда в месте возникновения дисбиоза: так, дисбиоз кишечника индуцирует аллергические поражения кожи, а дисбиоз кожи при атопическом дерматите – явления бронхиальной астмы.
Дисбиоз кожи – это, как правило, атрибут (причина или следствие?) нарушения ее барьерной функции разной степени выраженности, что является патогенетической основой старения кожи. То, что многие болезни кожи, по всей видимости, сопровождаются микробным компонентом, доказывается тем фактом, что антимикробная терапия дает в этом случае позитивные результаты. При этом так и не ясно, чем является вовлечение микробного компонента – причиной или следствием патологического процесса.
Поэтому заболевания кожи можно условно разделить на 2 группы:
- заболевания и патологические состояния, ассоциированные с резидентными (безопасными) микроорганизмами, в том числе заболевания, при которых безопасные микроорганизмы приобретают свойства патогенности;
- заболевания и патологические состояния, где роль микробиоты не ясна.
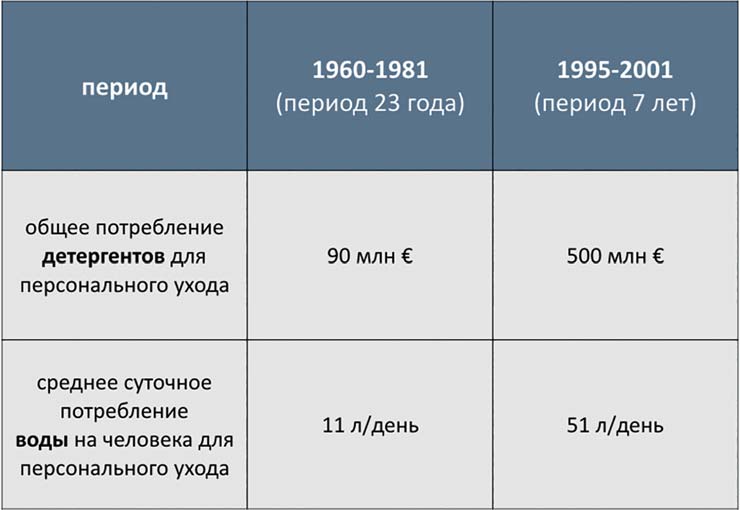
ТАБЛИЦА 5. Рост потребления детергентов и воды для персонального ухода в Великобритании за период с 1960 по 2001 г.
Себорейный дерматит
Поражает кожу головы и ассоциирован с дрожжеподобными грибами Malassezia spp., которые являются естественной микрофлорой кожи головы и питаются секретом сальных желез. В ряде случаев развивается состояние, когда доля этих микроорганизмов увеличивается, а метаболиты жизнедеятельности, пенетрируя в кожу, вызывают воспалительную реакцию и манифестацию заболевания.
Акне
Состояние ассоциировано с резидентной липофильной бактерией P.acnes, широко представленной на участках с высокой себопродукцией и обильно колонизирующей просвет и протоки сальных желез. Микроорганизм оснащен не только липазами, но и протеазами и гиалуронидазами, что способно повреждать структуру сальной железы. P.acnes содержит потенциально вирулентные структуры – поверхностные белки адгезии и порфирины, которые способны запускать воспалительную реакцию, особенно при состоявшемся нарушении строения сальной железы.
Атопический дерматит
Поражает до 15-20% детей и 2% взрослых (данные по США). По неизвестным причинам его распространенность практически утроилась в индустриально развитых странах за последние 30 лет. В России заболеваемость атопическим дерматитом у детей увеличилась за последние 5 лет на 16%. Ряд исследователей связывают такой рост с чрезмерными гигиеническими мероприятиями, особенно в Великобритании и США (табл. 5).
Интересно, что классические первичные проявления атопического дерматита встречаются в подъягодичной складке и передней поверхности локтевого сгиба – в двух зонах, имеющих очень схожую микробиоту, отличную от других участков. Существует предположение, что запуску атопического дерматита способствуют колебания в составе микробиоты кожи этих участков с последующим изменением интенсивности воздействия окружающих факторов на геном кератиноцитов в этой области и формированием воспалительной реакции.
Атопический дерматит ассоциирован с микробным дисбалансом – 90% пациентов с атопическим дерматитом колонизированы S.aureus (как в пораженных, так и здоровых областях кожи), в то время как в популяции здоровых индивидуумов массивное расселение золотистого стафилококка диагностировано не более чем у 5%. При атопическом дерматите отмечается выраженное угнетение локального иммунитета (на фоне стимуляции Th2), снижение выработки антимикробных белков и наблюдается значительно менее выраженное разнообразие микробиоты (при псориазе, наоборот, выявлена стимуляция иммунного ответа и рост синтеза антимикробных белков).
АНТИБИОТИКИ, ПРОБИОТИКИ И ПРЕБИОТИКИ
Антибиотики как вещества, вырабатываемые одной формой жизни для угнетения другой, широко распространены в живой природе, равно как и механизмы защиты и противостояния таким веществам. Поэтому появление антибиотиков на службе человека – абсолютно закономерный процесс, ведь сегодня открыто порядка 14 тыс. патогенов, которым нашему организму приходится противостоять. Другое дело, что нам еще предстоит научиться ювелирному применению антибиотиков, как это свойственно дикой природе, а не заниматься стрельбой из пушки по воробьям, причем, как выяснилось, с непоправимыми метаболическими последствиями для организма человека.
Антибиотики, которые применяет человечество для лечения заболеваний, делятся
- на природные (синтезированные живыми организмами)
- химически модифицированные, или полусинтетические
- синтетические
Примерами натуральных природных антибиотиков являются:
- синтезированные микроскопическими грибами – пенициллин, цефалоспорин, фузидин, гризеофульвин
- синтезированные актиномицетами – стрептомицин, тетрациклины, неомицин, эритромицин
- синтезированные бактериями – полимиксины
- полученные из животных тканей – люоцим (из бел ка куриного яйца), интерферон, (синтезированный лей коцитами), эктерицид (из рыбьего жира)
- полученные из растений (фитонциды) – хлорофиллипт (из эвкалипта), сальвин (из шалфея)
Химическая модификация антибиотиков применяется для улучшения каких-либо их свойств (пролонгированное действие, более высокая устойчивость к ферментам желудочно-кишечного тракта и/или ферментам бактерий). Например, бета-лактамные пенициллины и цефалоспорины.
К синтетическим антибиотическим препаратам относятся хинолины, хинолоны (фторхинолоны), сульфаниламиды, нитрофураны.
Механизмы действия всех антибиотиков принципиально можно разделить на 3 типа:
- прямое разрушение или нарушение синтеза/репарации бактериальной клеточной стенки;
- нарушение синтеза бактериальных белков, необходимых для различных аспектов жизнедеятельности бактерии (переваривание, размножение, передвижение, защита);
- нарушение процессов клеточного деления.
Несмотря на то, что врачи условно подразделяют антибиотики на препараты широкого и узкого спектра бактериального действия, с точки зрения микробиоты человека любой антибиотик затрагивает жизнедеятельность огромного количества микроособей. И здесь уже не важно, какое количество таксонов микроорганизмов было поражено прямыми механизмами, поскольку косвенным образом страдает весь микробиом. Применение любого антибиотика – это своего рода «ковровое бомбометание», что отражается на микробиоте всего организма человека.
Сегодня уже неоспоримо, что влияние антибиотиков на организм человека далеко не ограничивается их прямым антибактериальным действием.
Современная проблема антибиотиков заключается не только в лавинообразном распространении антибиотикорезистентных штаммов, которые расширяют как свои анти-антибактериальные возможности, так и ареал распространения, осваиваясь уже и в традиционном обществе, а не только в госпитальном с высоким скоплением ослабленных пациентов, как это было еще 5-7 лет назад. Системное применение антибиотиков привело/приводит к стойкому поражению микробиоты человека и метаболическим нарушениям в его организме.
Микробиота оказывает влияние на метаболизм человека, антибиотики оказывают влияние на микробиоту (не только изменяя микробиотический состав, но и само функционирование микроорганизмов), а значит, и на метаболизм макроорганизма. Как показано в современных исследованиях, это влияние стойкое и зачастую необратимое (особенно если произошло в детском возрасте).
Разовый курс антибиотикотерапии у человека при заболевании, не имеющем отношения к коже, нарушает микробиоту кожи количественно и качественно. Эти изменения микробиоты не восстанавливаются в течение 4 лет (а, может быть, и дольше, поскольку исследование длилось только 4 года). Таким образом, антибиотики оказывают воздействие на весь организм, все ткани, в том числе удаленные и не имеющие никакого отношения к основному заболеванию.
На безмикробных мышах показано, что в их крови циркулирует 52 вещества, а в крови их конвенциональных (обсемененных) сородичей – около 4200 (в 80 раз больше!). Иными словами, почти 99% химических соединений в макроорганизме (а именно в крови) синтезированы микроорганизмами непосредственно или под их управлением/контролем/влиянием. В организме человека происходят такие же процессы и в тех же пропорциях. Очевидно, что нарушения микробиоты под влиянием антибиотиков не могут не влиять на метаболизм макроорганизма.
Обсеменение безмикробных мышей кишечной микробиотой беременных женщин III триместра приводило к быстрому набору веса мышами. Этого не наблюдалось при применении у таких же безмикробных мышей кишечной микробиоты женщин I триместра беременности. Подобное исследование – пересаживание микробиоты тучных мышей безмикробным сородичам – тоже привело к быстрому набору веса последних. Эти исследования говорят о вовлечении микробиоты во все важные процессы макроорганизма, в данных случаях – более полное усвоение калоража пищи (в том числе (в первом случае) в качестве естественной подготовки организма к родам).
В исследовании, проводимом еще в 1963 году в США, сравнивали 2 группы цыплят – конвенциональных, с классическим обсеменением бактериями, и особым образом выведенных безмикробных. В каждой группе было по 2 подгруппы – с традиционным питанием или питанием с добавлением небольших доз антибиотиков. «Победителями» в скорости набора веса оказались традиционные обсмененные цыплята, рацион которых включал низкие дозы (ведь это были здоровые цыплята) антибиотиков. Интересно, что среди безмикробных цыплят разницы в наборе веса при использовании антибиотикового и классического питания не наблюдалось. Значит, антибиотики воздействуют на обмен веществ в макроорганизме, и осуществляется это опосредованно, через его микробиоту (что еще раз подчеркивает участие микробиоты в регуляции метаболизма макроорганизма). Это уже несколько забытое исследование объясняет, для чего в животноводстве применяются антибиотики в таких огромных количествах – не для профилактики/лечения животных (хотя это не отрицается), а для скорейшего набора ими веса.
Безмикробные мыши, обсемененные микробиотой мышей, прикармливаемых антибиотиками, тоже демонстрируют быстрый набор веса.
Более поздние исследования показали, что раннее начало применения антибиотиков у новорожденных мышат и цыплят (как в виде кратких курсов, имитирующих лечение от болезни, так и в виде низкодозированного постоянного прикорма) приводило к резкому набору веса за счет развития жировой и костной ткани (здесь стоит вспомнить пресловутые куриные «ножки Буша» с массивной костью). У самок это проявлялось быстрее и более выраженно. Практически любой антибиотик обеспечивает подобный эффект. Важно, что эти изменения были необратимы, и чем раньше начинали давать антибиотик, тем метаболические сдвиги в организме были сильнее. Механизм, скорее всего, связан с нарушением как состава микробиоты, так и функционирования бактерий, в результате чего повышается степень усвоения калоража пищи (в норме для человека – 5–15%). Спустя какое-то время микробиота может восстановиться в той или иной степени, но метаболические нарушения уже не корректируются.
Сегодня в животноводстве потребляется 75–80% производимых человечеством антибиотиков. Это предопределяет непрерывный, начиная с раннего возраста, прием низких доз антибиотиков человеком с продуктами питания – мясом, молоком, сырами, яйцами. Кроме того, за последнее время участились случаи передачи антибиотикорезистентных штаммов от животных к человеку. Это не может не вызывать беспокойство, поскольку, как показано в США, 87% мясных полуфабрикатов на полках магазинов заражены микроорганизмами животных.
В Швеции с 1986 года реализован запрет на использование антибиотиков в животноводстве (кроме случаев лечения заболеваний животных, хотя кто это может проконтролировать?). В Германии запрет введен в 1999 году и постепенно реализован к 2006-му. В России и США нет запрета на применение антибиотиков в животноводстве в качестве прикорма.
Вообще именно США является мировым лидером по использованию антибиотиков в целом, у людей в том числе (хотя есть данные, что Китай уже обогнал в этом смысле США в 2–4 раза). Конкуренцию США составляют некоторые европейские страны, лидирующие в этом процессе, – Греция, Турция и Франция. Аутсайдерами по назначению антибиотиков людям (в Европе) являются Нидерланды, Швеция, Эстония, Латвия и Россия. Самый продаваемый антибиотик в США – азитромицин из группы макролидов (на втором месте – амоксициллин).
По данным за 2010 год, в среднем в США назначается 833 курса антибиотикотерапии на 1000 человек в год (для сравнения: в Швеции – 388), в том числе детям до 2 лет – 1365 на 1000 детей в год. Причем в США антибиотик дается новорожденному «для профилактики» сразу после эвакуации из родовых путей матери. В среднем в США ребенок за первые 2 года жизни получает 3 курса антибиотиков (в Швеции – менее 1,5 курсов за первые 3 года жизни), к 10 годам – 11, к 20 годам – 17, к 40 годам – порядка 30.
Однако при такой разнице частоты применения антибиотиков у детей младенческая и детская смертность в Швеции не отличаются от таковой в США. Но широкая практика в США по применению антибиотиков с раннего возраста, по всей видимости, имеет другие последствия, с годами все более явно проявляющиеся в популяции.
Как показано выше, антибиотико-метаболическое воздействие на организм наиболее критично в раннем детстве, когда ребенок интенсивно растет (до 3-го года жизни). Применение антибиотиков в младенческом возрасте (курсовое или перманентное низкодозированное) приводит к сбоям в составе микробиоты (которая раньше или позже может восстановиться), необратимым метаболическим нарушениям и росту на 50% риска набора избыточной массы тела. Этот риск еще выше, если мать младенца сама страдает избыточной массой тела и при рождении обсеменяет новорожденного своей не совсем корректной микробиотой, свойственной людям с ожирением. Показано, что люди, страдающие ожирением, характеризуются значительно менее выраженным разнообразием микробиоты в кишечнике – всего лишь 40 тыс. генов против 800 тыс. генов у обычных людей. Каково здесь причинно-следственное направление, еще предстоит установить, но есть серьезные основания полагать, что эра антибиотиков (и, как следствие, – истощение разнообразия микрофлоры, находящейся под «антибиотиковым давлением») напрямую влияет на развитие эпидемии ожирения.
Антибиотикотерапия, проведенная в раннем возрасте, и ожирение у матери представляют собой негативные факторы, повышающие риск развития ожирения у ребенка уже в детстве. Однако такая же картина наблюдается и при сочетании кесарева сечения и ожирения у матери, что еще раз обращает внимание на кесарево сечение как неблагоприятный фактор динамики созревания микробиоты у новорожденного.
Кроме того, все более отчетливо прослеживается связь широкого применения антибиотиков детьми раннего возраста (начиная с 80–90-х годов прошлого века) с ростом распространенности следующих заболеваний:
- ювенильного диабета (удвоение заболеваемости в развитых странах каждые 20 лет и сдвиг манифестации в более ранний возраст – к 2-6 годам!);
- астмы (рост заболеваемости за последние 15 лет на 50%; по некоторым данным, патологией страдает до 10% населения США);
- пищевых аллергий (например, на арахисовое масло – отмечается рост патологии в 3 раза за последние 20 лет; в США заболеванием страдает каждый 5-й ребенок);
- язвенных поражений толстой кишки (язвенный колит и болезнь Крона) – каждый курс антибиотиков увеличивает риск развития таких заболеваний на 18%, а заболевшие принимали антибиотики в своей жизни в 2 раза чаще остальных;
- целиакии (в результате чего гонениям подвергается безобидный белок зерновых глютен, который рассматривают как причину аутоиммунных атак на клетки кишечного эпителия. Наблюдается колоссальный рост заболевания за последние 20 лет – +300% по сравнению с уровнем заболеваемости в 1950 году);
- аутизма (заболеваемость увеличилась в 4 раза по сравнению с 1960 годом; в клинических исследованиях подтвержден ненормальный уровень серотонина, необходимого для функционирования центральной нервной системы, на фоне проводимых ранних курсов антибиотикотерапии).
Может быть, все эти проблемы высокоразвитого американского общества – следствие безудержного и по малейшему поводу лечения антибиотиками, культивировавшегося в США, начиная с 80–90-х годов XX века, особенно в отношении младенцев и детей?
На фоне всего вышеизложенного уже совсем не парадоксально звучит заключение ряда исследователей – после антибиотикотерапии человек более восприимчив к другим заболеваниям с инфекционным компонентом (поскольку защитные свойства собственной микробиоты ослаблены или потеряны). По некоторым возбудителям подобная восприимчивость вырастала в 30 тыс. раз!
Таким образом, чтобы не оказаться в условиях «антибиотиковой зимы» (при этом нисколько не умаляя роль этих средств, спасших миллионы жизней за последние 75 лет), человечество вынуждено переосмыслить важность взаимодействия макроорганизма с микроорганизмами, изучить и взять на вооружение принципы этого взаимодействия. Про- и пребиотики – это пока первая попытка в данном направлении. Эти принципы могут лечь и в основу лечения многих патологических состояний человека. Концепция терапии (даже инфекционного заболевания), в основе которой лежит уничтожение возбудителя, на современном этапе трансформируется в сторону мероприятий , направленных на восстановление естественного микробиоценоза, свойственного конкретному индивидууму.
В основе нового лечебного принципа лежит индивидуальное восстановление индивидуальной микробиоты на основе селективного подбора биотических продуктов в зависимости от патологии (т.е. доминирующего инфекционного агента), состояния микробиоты и иммунной системы человека. Нам еще предстоит освоить такую детальную диагностику индивидуальной микробиоты пациента для развития настоящей персонализированной медицины и косметологии.
Иными словами, как болезнь развивается в контексте особенностей статуса макроорганизма и его микробиоты, так и ее лечение должно подбираться индивидуально с учетом обоих факторов (классическая медицина пока предполагает учет только статуса макроорганизма).
Несмотря на то, что про- и пребиотические продукты уже широко вошли в повседневную жизнь (табл. 6), не совсем ясно, каковы молекулярные механизмы их действия. Учитывая, что существенной колонизации поверхностей пробиотическими бактериями не происходит, механизм действия пробиотиков, безусловно, включает возможность вытеснять патоген. Но, скорее всего, основная их роль состоит в глобальном изменении баланса как внутри микробиоты, так и в системе ее взаимодействия с организмом хозяина. Действие про- и пребиотиков является мультифакториальным, что выглядит многообещающим.
Сам принцип использования микроорганизмов для корректировки патологических состояний, также обусловленных/ассоциированных с микроорганизмами, выглядит логичным и перспективным. С одной стороны, микробиота человека – это отличный источник знаний, как подобное лечить подобным. С другой стороны, микроорганизмы способны обеспечить практически любой химический процесс в наших интересах.
Основателем пробиотической терапии стал русский микробиолог Илья Мечников, который в конце XIX века выделил из йогурта, составлявшего существенную часть диеты болгарских пастухов, «болгарскую палочку». Мечников описал свойства чистых культур молочнокислых бактерий и отдельных штаммов лактобацилл, а также способствовал производству первого бактериального препарата – Лактобациллина: он появился в продаже в 1912 году в Санкт-Петербурге. Исследования Мечникова в области полезных бактерий имели мировой резонанс, который сошел на нет с открытием антибиотиков в 1928 году (стоит задуматься о философской роли антибиотиков в истории человечества).
До 80-х годов XX века Советский Союз был единственной (!) страной в мире, где занимались пробиотиками. К тому времени в нашей стране было проведено значительное количество исследований , подобраны наиболее эффективные штаммы пробиотиков, установлена их антагонистическая активность по отношению к патогенам, разработан целый ряд уникальных методик, позволяющих оценить действие бактерий в организме. В промышленном масштабе уже создавались лекарственные препараты на основе лактобацилл, энтерококков, бифидобактерий и кишечной палочки (Колибактерин, Лактобактерин, Бифидумбактерин, Бификол).
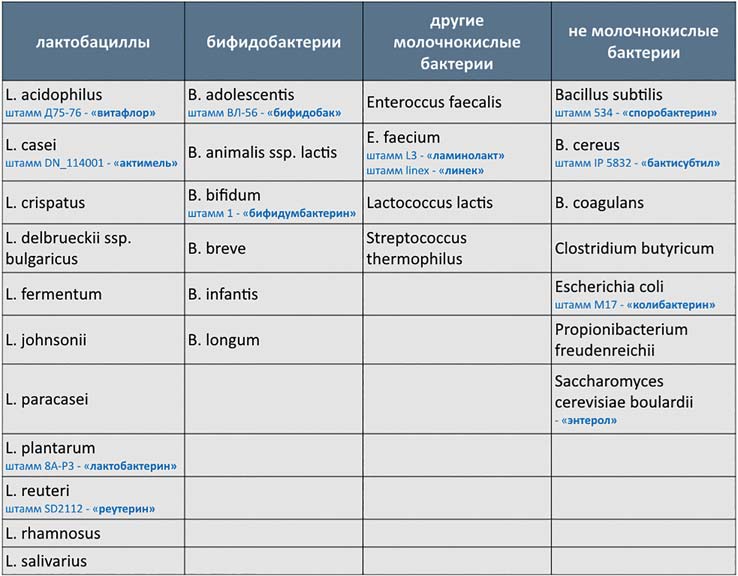
ТАБЛИЦА 6. Наиболее распространенные пробиотические микроорганизмы и пероральные лечебные препараты на их основе
С момента возникновения концепция пробиотиков претерпела существенные изменения. Термин «пробиотик» (от греч. pro bios – для жизни) впервые был применен Lilly и Stillwell в 1965 году. В 1974-м Parker уже определил пробиотики как «микроорганизмы и субстраты, оказывающие позитивное воздействие на микробный баланс кишечника». Fuller в 1989 году заявил: «Пробиотики – это пищевая добавка из живых микроорганизмов, которая оказывает позитивное воздействие на организм хозяина благодаря улучшению микробного баланса». Salminen в 1998 году дал другое определение этим соединениям: это «пища, содержащая живые бактерии, что полезно для здоровья макроорганизма». Marteau в 2002 году отмечал, что пробиотики – это «препарация микробных клеток или микробных компонентов с подтвержденным эффектом для здоровья и жизни человека». И, наконец, в 2001 году ВОЗ дала официальное определение: пробиотики – это живые микроорганизмы, применение которых в адекватных количествах обеспечивает полезное действие на организм хозяина.
Сегодня восстановление микробиоты как таковой не является основной целью применения биотических препаратов. Задача гораздо шире: путем восстановления нормальной микробиоты обеспечить корректное взаимодействие в системе «микроорганизмы – макроорганизм», сбалансировать метаболический/иммунный статус макроорганизма и эффективное участие в нем микробиоты. Важно, что собственная микробиота является огромным резервуаром для познания новых идей и механизмов для такого биомиметического лечения человека.
Пребиотики – это вещества, способствующие качественному и количественному восстановлению естественной микробиоты в конкретной экологической нише. Концепция пребиотиков была сформулирована Gibson и Roberfroid в 1995 году (в 2004 году была адаптирована для косметики благодаря введению понятия «пребиотический коэффициент»). Задача пребиотика – создать комфортную среду для размножения позитивных бактерий и некомфортную – для роста патогенов. В связи с этим спектр классических пребиотиков может быть расширен за счет ряда готовых бактериальных метаболитов, позволяющих их производителям доминировать в ареале обитания. Чаще всего для восстановления микрофлоры кишки используют неперевариваемые ферментами желудочно-кишечного тракта полисахара, а для кожи – инулин, который обладает позитивным действием по отношению к S.epidermidis.
В настоящее время также применяются:
- симбиотики – комбинация нескольких пробиотиков (считается, что пробиотический эффект от нескольких симбионтов сильнее, чем от одного изолированного пробиотика);
- синбиотики – комбинация пробиотика и пребиотика.
Сейчас пробиотики как компоненты функционального питания или лечебные препараты широко применяются во всем мире. Большинство используемых пробиотических штаммов относится к группе молочнокислых бактерий (Lactic Acid Bacteria, LAB), или бифидобактерий. В России более 80% рынка пробиотиков составляют препараты на основе энтерококков (Линекс и Бифиформ). Среди других пробиотических штаммов используются разные виды бацилл, кишечной палочки, сахаромицетов и некоторых бактероидов и клостридий .
Большинство штаммов, продуцирующих антимикробные пептиды, ингибирует рост весьма ограниченного набора штаммов бактерий с аналогичными предпочтениями по колонизации. Некоторые пробиотики (L.plantarum 8P-A3 или E.faecium L3) способны синтезировать несколько бактериоцинов с чрезвычайно высокой ингибирующей активностью в отношении широкого спектра как грамположительных, так и грамотрицательных патогенных микроорганизмов.
Высокоэффективным является запатентованный комплекс VSL#3, включающий 4 разновидности Lactobacilli, 3 разновидности Bifidobacteria и Sterptococcus Salivarius subsp. thermophilus.
Несмотря на то, что антибиотики представляют собой наиболее мощные продукты для коррекции микробиоты, они должны быть зарезервированы для крайне выверенного и редкого применения, тем более что пробиотики зарекомендовали себя с положительной стороны даже при лечении тяжелых воспалительных заболеваний внутренних органов. Пробиотики селективно действуют на патогенные бактерии и в большинстве случаев лишены побочных эффектов, которые неизбежны при использовании антибиотиков и антисептиков. Обещающими выглядят возможности лечения респираторных заболеваний, кариеса и периодонтита, ревматоидного артрита, заболеваний печени, диабета, ней родегенеративных заболеваний и даже онкологических состояний. Кроме того, с помощью пробиотиков можно корректировать микробиоценоз для защиты от потенциальных инфекций .
Одной из разновидностей пробиотической терапии является пересадка микроорганизмов в виде фекальной трансплантации. Эта медицинская процедура основана на полной замене микробиоты кишечника человека, страдающего дисбиозом, микробиотой здорового донора. К настоящему времени проведено много клинических исследований полной замены микробиоты у пациентов с воспалительным заболеванием кишечника или с псевдомембранозным колитом (истощающий жидкий стул), вызванным Clostridium difficile. На фоне неоднократных курсов антибиотикотерапии резко снижается разнообразие и пластичность микробиоты толстой кишки – нерезистентные штаммы исчезают и начинают доминировать резистентные штаммы, которые могут быть в микробиоте и в норме, но в небольших количествах. Лечение позволяет устранить подобный дисбаланс. Основной недостаток фекальной трансплантации заключается в том, что эта процедура не учитывает персональные особенности микробиоты, что край не важно для создания устойчивого консорциума бактерий . Существуют сложности и с подбором адекватного донора, ведь знаний о микробиоме и особенно его вирусной составляющей , которая может вызывать отдаленные патологические реакции, пока явно недостаточно. Тем не менее фекальная трансплантация, даже в таком не идеальном виде, в 3 раза более эффективна, чем классическая антибиотикотерапия.
Более мощной альтернативой может быть подход, основанный на использовании штаммом собственных бактерий человека для восстановления нормальной микробиоты в случае дисбиотических состояний . Применение аутопробиотиков или персонифицированной симбионтной терапии предполагает выделение отдельных представителей микробиоты в виде чистых культур, их генетический анализ и возвращение обратно в желудочно кишечный тракт после размножения вне организма. Обычно процедура от забора микробиоты до подготовки аутопробиотика в виде молочнокислой закваски занимает одну неделю, что позволяет пользоваться технологией даже в условиях клиники.
Учитывая взаимосвязь микробиоты различных отделов человеческого тела, нормализация кишечной микробиоты представляет собой важное мероприятие, в том числе и по воздействию на кожу. Уже доказано, что состояние кожных покровов напрямую зависит от микробиоты кишечника, но детальные исследования эффективности пробиотиков для прямой терапии кожных поражений /состояний еще впереди.
ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ В КОСМЕТОЛОГИИ
В связи с вышесказанным важнейшим компонентом косметологических процедур должно стать грамотное применение биотических продуктов – пробиотиков, пребиотиков и их комбинаций. Поскольку кожа имеет собственную микробиоту, воздействие на нее может быть полезным в косметологии, в том числе в комплексной коррекции процессов старения (тем более учитывая, что микробиота кожи тоже «стареет», т.е. изменяется с возрастом).
Требования к пробиотикам косметического применения несколько другие, чем к кишечным пробиотикам – они должны обладать выраженной адгезией к ороговевшим кератиноцитам и синтезировать антибактериальные вещества (понятно, что все группы пробиотиков должны быть безопасными). Некоторым ограничением для пробиотиков является небольшой срок годности и необходимость хранения готового косметического продукта в холодильнике для поддержания активности культуры микроорганизмов. Кроме того, не снята с повестки дня настороженность по поводу генной модификации бактерии (хотя на фоне глобальной емкости метабиома, на два порядка превосходящего геном человека, это вряд ли актуально). Именно поэтому первым на косметическом рынке в 2005 году появился пребиотический продукт, содержащий экстракты сосны, черной смородины и женьшеня для лечения акне.
Поскольку любой косметический продукт, нанесенный на кожу для ее увлажнения или улучшения барьерных свойств, фертилизуется микробиотой, очевидно, что косметическая рецептура, находясь в контакте с микробиотой, сама по себе является хорошей отправной точкой биотической терапии. Возможно, в скором времени мы сможем этим пользоваться осознанно, изначально формируя рецептуры с учетом потребностей микробиоты кожи, закладывая определенные направления для коррекции ее состояния (по-разному для различных участков тела). Особую роль играют суровые условия существования микроорганизмов на коже с низким содержанием питательных веществ. Избыток или недостаток какого-либо пищевого компонента способен оказать существенное влияние на микробиоту и опосредованное ею состояние кожи. А воздействие на микробиоту, ввиду ее «интимной связи» с иммунной системой кожи, открывает широкие горизонты для получения и применения высокоадаптированных тканьспецифичных адъювантов для точечного усиления иммунных компонентов при сохранности гомеостаза.
В настоящее время проводятся интересные исследования по использованию пробиотиков в косметологии. Как показано выше, огромное влияние на состояние кожи оказывает состояние микробиоты желудочно-кишечного тракта, поэтому это могут быть как пробиотики перорального применения, так и накожного.
Доказано, что пробиотики способны воздействовать на ряд anti-age процессов.
- Нормализовать повышающийся с возрастом рН кожи. В норме рН кожи составляет 4,2–5,6 и с возрастом имеет тенденцию к повышению. Кислый рН формируется за счет высвобождения свободных жирных кислот и высокого содержания свободных аминокислот. Это является необходимым условием для поддержания высокой эффективности эпидермального барьера (за счет активности ферментов кератинизации), гидратации эпидермиса (в том числе за счет аминокислот) и антимикробных свойств. Увеличение рН приводит к падению активности ферментов синтеза церамидов, возрастанию активности протеаз (матриксметаллопротеаз) и ускорению десквамации. Доказано, что пробиотики на коже способны ферментировать жирные кислоты сального секрета, восстанавливая не только рН, но и весь гомеостаз в эпидермисе и дерме (см. ниже).
- Увеличивать содержание церамидов и свободных жирных кислот в эпидермисе, улучшая баланс основных компонентов липидных ламелл и усиливая эпидермальный барьер. Показано, что Sterptococcus Salivarius subsp. thermophiles обладает высокой активностью сфингомиелинидазы и может обеспечивать синтез церамидов из «сырья» хозяина, восстанавливая, таким образом, качество эпидерамального барьера. Кроме того, есть понимание, что церамиды и их производные являются сигнальными молекулами и оркестрируют весть спектр процессов кератинизации. Соответственно, улучшение оборота церамидов в эпидермисе является важным фактором восстановления его гомеостаза с итоговым улучшением состояния кожи.
- Помимо указанного механизма исследованы и другие варианты усиления эпидермального барьера и качества кератинизации. Например, Lactobacillus helveticus в виде живой или лизированной культуры способен стимулировать синтез кератиноцитами филаггрина как ключевого белка кератинизации. Или S.epidermidis в виде изолированной (отдельно культивированной), обогащенной и возвращенной хозяину культуры усиливает собственную популяцию, повышает плотность примыкания кератиноцитов друг к другу.
- Противостоять окислительному стрессу в коже. Окислительный стресс является мощным патогенетическим механизмом старения кожи. Большая роль принадлежит УФ-лучам как источнику интенсивных окислительных процессов во всех слоях кожи. Для некоторых пробиотиков выявлена способность локально повышать в коже активность собственной супероксиддисмутазы и обеспечивать дополнительную защиту от пероксидов. Интересные данные получены для микроорганизма Lactobacillus Johnsonii NCC 533 (La1), пероральное применение которого в течение 2 месяцев привело к достоверному сокращению сроков восстановления кожи после УФ-повреждения. Кроме того, показано, что Lactobacillus rhamnosus GG генерирует пептиды, защищающие клетки эпителия от развития апоптоза в условиях стресса.
- Способствовать синтезу коллагена/эластина/гиалуроновой кислоты и снижать активность матриксметаллопротеаз. Существует два основных регуляторных механизма, определяющих обмен коллагена, – это трансформирующий фактор роста TGF-ß и транскрипционный фактор AP-1. Первый приводит к усилению синтеза коллагена I и III типа, второй – к активизации матриксметаллопротеаз (сочетание MMP-1, MMP-2, MMP-3 и MMP-9 способно полностью разрушить матрикс дермы). С возрастом TGF-ß инактивируется, фактор AP-1, наоборот, повышает активность, причем в этом процессе значительная роль может принадлежать УФ-облучению. Более того, после 40–50 лет резко снижается экспрессия гена эластина, что только ухудшает картину старения кожи. Показано, что пробиотики способны замедлять старение кожи именно за счет снижения активности протеаз MMP (например, VSL#3 при пероральном применении). Лизат Lactobacillus planetarium K8 или некоторых Bifidobacterium способствовал усилению синтеза гиалуроновой кислоты в дерме (как при пероральном, так и накожном применении).
- Обеспечивать возрастную иммуномодуляцию. Иммунная система кожи также стареет с возрастом, причем это затрагивает как клеточный, так и гуморальный ее компонент. Искажение провоспалительного/аллергического статуса оказывает влияние на снижение барьерных свойств. В исследованиях показана активность ряда пробиотиков в замедлении старения иммунной системы, корректном балансировании про- и противовоспалительных цитокинов, изменении синтеза NO. Некоторые штаммы Bifidobactrium отличаются выраженным противовоспалительным действием и способностью сохранять популяцию клеток Лангерганса в эпидермисе, угасающую с возрастом и/или при интенсивном УФ-облучении.
В дальнейшем, возможно, будет доступно использование пробиотиков для различных косметических продуктов, а именно:
- солнцезащитных (например, каротинопроизводящие дрожжи Rhodotorula);
- ранозаживляющих (например, после лазерных воздействий);
- применяемых при заболеваниях кожи (уже доказано позитивное действие пробиотиков для профилактики манифестации атопического дерматита);
- улучшающих качество волос.
Возможно, появятся особые системы доставки пробиотиков, оснащенные биосенсорами и высвобождающие бактерии при достижении наиболее благоприятных для их жизнедеятельности условий окружающей среды. А оснащение пробиотических бактерий геном синтеза бетаина уже делает их значительно более устойчивыми в широком диапазоне параметров окружающей среды.
Микроорганизмы, применяемые в качестве пробиотиков, ферментативно высокоактивны, поэтому представляет интерес применение их метаболитов (микроорганизмы способны освоить для нужд человека практически любой химический процесс). Такие продукты находятся на стыке про- и пребиотиков, поскольку имеют отношение к микроорганизмам, но это уже не живые бактерии. Они аккумулируют свойства пробиотиков, но лишены некоторых технологических недостатков живых культур (ограниченная жизнестойкость, уязвимость при колонизации ниши). Таким образом, были созданы технологии бактериальной ферментации для получения биотических продуктов накожного косметического применения. При этом бактерии с определенными метаболическими свойствами культивируются в средах с добавлением питательных веществ. После накопления в среде требуемых бактериальных метаболитов (как правило, это сложный коктейль метаболитов) сами бактерии либо удаляются, либо подвергаются лизису, обогащая среду еще и внутриклеточными активными веществами. Технологии бактериальной ферментации позволяют получать наиболее полные и сбалансированные коктейли бактериальных (уже готовых к употреблению) метаболитов с естественным/мягким/многокомпонентным корректирующим воздействием на микробиоту и клетки кожи ввиду близости такой технологии к естественным процессам, протекающим на поверхности эпидермиса (рис. 14).
В настоящее время на основе новейших технологий разработан ряд косметических ингредиентов биотического действия.
Ferment®Oil (United Active, Южная Корея)
Семейство различных ферментированных масел, из которых удаляются микроорганизмы по окончании технологического цикла. Каждый такой продукт представляет собой мономасло с высочайшим содержанием свободных жирных кислот (в десятки и сотни раз выше, чем в оригинальном масле). Технология предусматривает ферментацию бактериями, разрушающими эфирные связи в молекулах триглицеридов с высвобождением свободных жирных кислот. По сути, это мимикрия естественного процесса, происходящего на поверхности кожи в норме (рис. 15). Ферментации может подвергаться любое масло (или их смесь), уникальное не только по своему набору свободых жирных кислот, но и липофильных примесей. Данный продукт восстанавливает баланс трех основных компонентов липидных ламелл (жирные кислоты, церамиды, холестерол), где именно свободные жирные кислоты являются самым слабым звеном. Помимо этого такие масла значительно технологичнее, поскольку легче эмульгируются, дают более стойкие эмульсии и быстро усваиваются кожей без присущей маслам липкости.
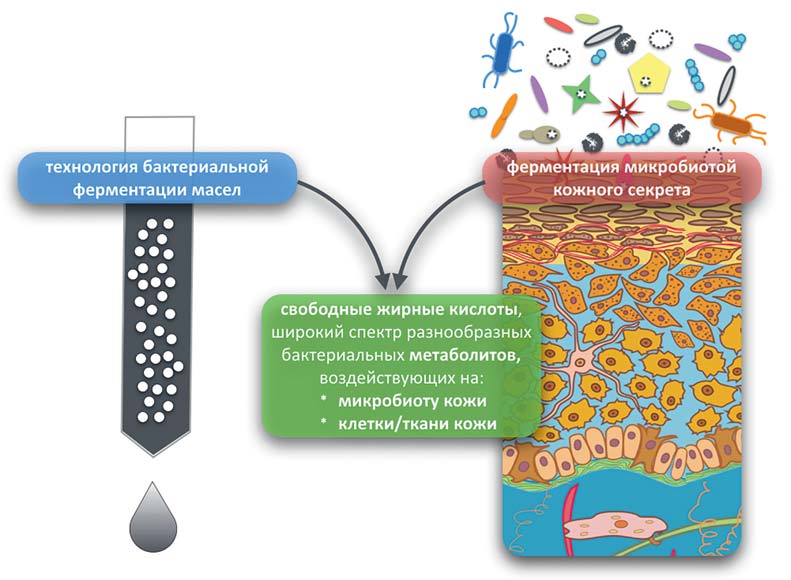
РИС. 14. Биологическое сродство технологии бактериальной ферментации масел и естественных процессов, протекающих в поверхностных слоях эпидермиса
U-ferment® FE (United Active, Южная Корея)
Продукт, близкий к предыдущему, представляет собой ферментированное масло. Специальный подбор масел и микроорганизмов обеспечивает итоговому продукту высокое содержание особых бактериальных метаболитов, обладающих свойствами натурального биосурфактанта, дружественного к микробиоте человеческой кожи и к самой коже. Рекомендуется для ухода за кожей детей первого года жизни и при чувствительной коже.
Дальнейшее развитие технологии ферментации масел ведется в направлении насыщения ферментированного продукта специализированными метаболитами, усиливающими иммунные свойства кожи, стрессустойчивость клеток кожи и способность синтезировать факторы кератинизации и компоненты матрикса дермы.
U-ferment® SVB (United Active, Южная Корея)
Продукт стандартизированной бактериальной ферментации трех растительных экстрактов, содержащий 7 витаминов группы B (B1, B2, B6, B12, фолиевая кислота, никотинамид, пантотеновая кислота). Данные витамины являются «всего лишь» следствием жизнедеятельности ряда бактерий. Но их польза для клеток кожи крайне велика по многим причинам. Более того, учитывая то, что поверхность кожи – это суровая среда обитания с лимитированным доступом к питательным веществам, данные витамины являются мощным метаболическим подспорьем для жизнедеятельности и нормальной микробиоты.
U-ferment® BF (United Active, Южная Корея)
Ингредиент представляет собой (1,3)(1,6) ß-глюкан – продукт ферментации черных дрожжей, более дешевый и доступный по сравнению с существующими на рынке ввиду конвейерной технологии биопроизводства. Обладает выраженным увлажняющим действием. Уникальная внутримолекулярная (1,3)(1,6) химическая связь, характерная для микроорганизмов и не свойственная организму человека, делает его неуязвимым для ферментов кожи. Характеризуется выраженным иммуномодулирующим эффектом, по всей видимости, благодаря функционированию в качестве лиганда рецепторов PRR и тонизирования иммунной системы эпидермиса (иммунный праймер) (рис. 9).
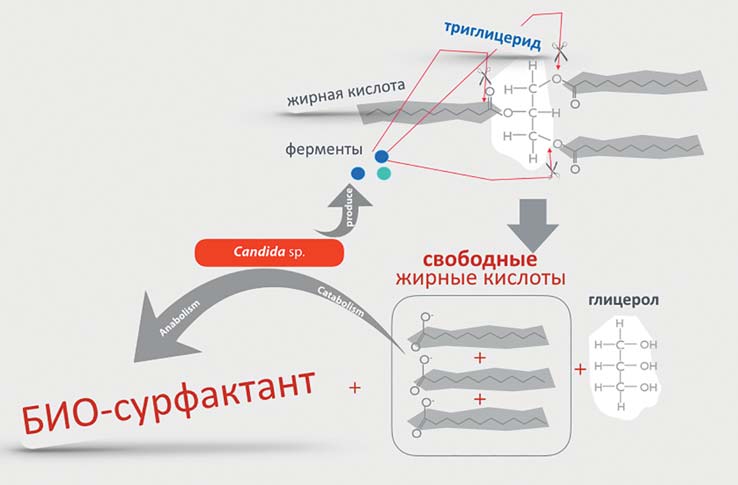
РИС. 15. Принципиальная схема ферментации масел для насыщения их свободными жирными кислотами, биосурфактантами и другими бактериальными метаболитами
U-ferment® FB (United Active, Южная Корея)
Особый ферментированный экстракт сои с естественным высоким содержанием биофлавоноидов как бактериальных метаболитов.
U-ferment® Vitide (United Active, Южная Корея)
Специальным образом ферментированный экстракт сои, насыщенный особыми высокомолекулярными метаболитами для удержания воды в эпидермисе и формирования менее агрессивной среды обитания для микробиоты кожи.
B9-Vitapol® (Labio, Южная Корея)
Продукт бактериальной ферментации, подавляет накопление в P.acnes порфирина и, как следствие, снижает выраженность ассоциированной с ним воспалительной реакции.
Ведутся интересные исследования по ферментации риса девятью бактериями, свойственными микробиоте рисовых зерен. Этот пребиотик для кожи лица способствует восстановлению ее микробиоты, повышению плотности и эластичности дермы, оказывает цитопротекторное действие.
Ферментация сока алоэ бактериями микробиоты алоэ показала интересную способность нормализовать микробиоту рук с позитивным транзиторным эффектом, реализующимся на коже… лица!
Нельзя забывать о том, что поддержание способности кератиноцитов синтезировать собственные антибактериальные пептиды является мощным натуральным механизмом сохранения здоровья микробиоты кожи. Помимо этого, возможно, применение витамина D3 (Aqua-ProVita®D3, Labio, Южная Корея) имеет еще большее значение в отношении микробиоты человека и нормализации взаимодействия микроорганизмов и макроорганизмов: есть данные о том, что хронические заболевания возникают в результате того, что микроорганизмы могут жить внутри клеток и выключать VDR-рецептор к витамину D, запуская массивный каскад осложнений по всему организму человека.
ВЫВОДЫ
Микробиота человека – это продукт коэволюции микроорганизмов и человека.
Микробиота человека включает в 10 раз больше клеток и в 100 раз больше генов, чем организм человека. Она формирует еще один метаболически активный и важный орган в организме человека.
Микробиота человека – это динамичная система, являющаяся результатом тесного взаимодействии с системами макроорганизма и факторами внешней среды.
Микробиота обеспечивает метаболическую поддержку организму хозяина, управляет созреванием и тонизирует иммунную систему человека, ей принадлежит уникальная регуляторная функция.
Научные исследования свидетельствуют о вовлечении микробиоты в развитие и течение неинфекционных заболеваний.
Микробиота человека – это источник знаний/технологий для будущих пробиотических методик диагностики и лечения человека.
Неограниченное применение антибиотиков в последние 30-40 лет (особенно у детей до 3 лет и в животноводстве), грубо вторгающихся в жизнь микробиоты человека, по всей видимости, является одной из причин широкого распространения ожирения, ювенильного диабета и аллергических заболеваний.
Доступные на современном этапе про- и пребиотические препараты способны оказывать существенное полезное (системное) воздействие на организм человека.
Пробиотики и пребиотики можно применять в косметологии для коррекции состояний кожи и anti-age воздействия.
Технология бактериальной ферментации имеет сродство с естественными процессами, протекающими на поверхности кожи, и позволяет получать широкий спектр эффективных, готовых к применению бактериальных метаболитов для косметического использования с целью корректного комплексного воздействия на экосистему поверхности кожи и состояние самой кожи.
Источник - Журнал по прикладной эстетике. Les nouvelles esthetiques. Новости эстетики. 2017 г. №3
-
.jpeg) 24 июляМикроигольчатый RF лифтинг. Особенности...Микроигольчатый RF лифтинг – это управляемое дозированное повреждение кожи и ее глубоких слоев с использованием современных технологий для глобальной стимуляции процессов обновления тканей.
24 июляМикроигольчатый RF лифтинг. Особенности...Микроигольчатый RF лифтинг – это управляемое дозированное повреждение кожи и ее глубоких слоев с использованием современных технологий для глобальной стимуляции процессов обновления тканей.
-
.jpeg) 11 июляСамые современные и безопасные...Солнцезащитные средства становятся одними из самых необходимых продуктов по уходу за кожей. Ведь уже ни для кого не секрет, что ультрафиолетовые лучи (UVA и UVB) вызывают фотостарение,...
11 июляСамые современные и безопасные...Солнцезащитные средства становятся одними из самых необходимых продуктов по уходу за кожей. Ведь уже ни для кого не секрет, что ультрафиолетовые лучи (UVA и UVB) вызывают фотостарение,...
-
 24 июняСпециалисты рекомендуют средства...Санскрины — одни из самых дорогих ингредиентов.
24 июняСпециалисты рекомендуют средства...Санскрины — одни из самых дорогих ингредиентов.
-
.jpg) 01 августаПРЕДОСТАВЛЯЕТ ВАМ БЕСПЛАТНЫЙ ДОСТУП К...
01 августаПРЕДОСТАВЛЯЕТ ВАМ БЕСПЛАТНЫЙ ДОСТУП К...
-
 13 июляОсобенный биоревитализант с янтарной кислотой
13 июляОсобенный биоревитализант с янтарной кислотой
-
 13 июляEricson Laboratoire представляет EYE ZONE...
13 июляEricson Laboratoire представляет EYE ZONE...
